Información sobre la práctica:
La fórmula leucocitaria o también llamada recuento diferencial leucocitario (RDL) consiste en la determinación del porcentaje de cada uno de los distintos tipos de leucocitos con respecto al total de ellos.
Materiales utilizados:
-Papel de filtro.
-Portas.
-Lanceta.
-Gasas.
-Gradilla.
-Capilar heparinizado.
-Microscopio óptico.
-Papel y lápiz o registrador automático de células.
El registrador automático de células es un aparato con unas teclas.Cada tecla representa un tipo de leucocito y cada vez que observas uno de cada tipo presionas un botón distinto.Cuando el número de anotaciones llega a 100, suena una alarma.
-Aceite de inmersión.
-Alcohol para desinfectar la zona de donde vamos a sacar sangre.
-Cubetas de Wertheim o similares.
Muestra:
En esta práctica decidimos utilizar sangre capilar fresca, para ello tuvimos que desinfectar la zona con alcohol y con la lanceta pinchar el tercer o cuarto dedo de una mano.Después tuvimos que desechar la primera gota de sangre y el resto la recogimos con el capilar heparinizado.
Objetivos:
-Decir con qué objetivo del microscopio se observan los leucocitos cuando se determina una fórmula leucocitaria.
-Explicar cómo es el recorrido que se describe en la observación leucocitaria.
-Decir cuándo se han de observar al menos 200 leucocitos.
-Si de 100 leucocitos observados, 20 son linfocitos y el WBC es igual a 7.000 leucocitos/ mm cúbico de sangre, ¿cuál es el número de linfocitos que hay en 1 mm cúbico de sangre?
-Decir cómo se llama el aumento de los monocitos.
Procedimiento:
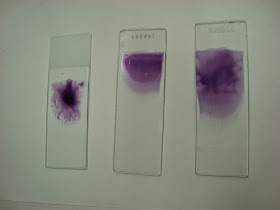
1.Primero hay que realizar una extensión sanguínea con la sangre fresca.
2.Dejamos la extensión secar y procedemos a utilizar una tinción para poder observar mejor los leucocitos. Se puede realizar : Giemsa, Wright o Panóptico rápido, escogimos la última porque es la más rápida de realizar, apenas 15 segundos.
3.La tinción del Panóptico rápido se realizó en una práctica anterior por lo que el procedimiento no lo explicaremos en esta práctica.
4.Para observar la muestra al microscopio óptico tenemos que poner el condensador alto y el diafragma abierto.
5.Enfocar con el objetivo de 10 x.
6.Después añadimos aceite de inmersión para observar con el objetivo de 100 x.
7.Finalmente hay que ir contando la cantidad de leucocitos de cada tipo e id anotando.
El contaje se puede realizar con lápiz y papel dibujando unas columnas que representen cada una un tipo de leucocito, y se traza una raya en la columna correspondiente cada vez que se ve un leucocito.La otra forma es con el registrador automático de células.
Lectura de resultados:
Cuanto mayor es el número de leucocitos contados más exacta es la determinación.En práctica se cuentan 100 leucocitos o, como máximo 200.
Si se encuentra un mayor número de linfocitos que de neutrófilos ( en el adulto) o más de un 10% de eosinófilos o más de un 12% de monocitos, la fórmula leucocitaria se hace contando 200 leucocitos y dividiendo posteriormente el resultado que hemos obtenido entre 2.
Cálculos:
Conociendo el recuento de leucocitos (número de leucocitos por mm cúbico de sangre ) , se puede calcular el número de cada uno de los tipos de leucocitos que está presente en 1mm cúbico de sangre.Se realiza a partir de la siguiente fórmula:
nº TL = (WBC x % TL) / 100
nº TL = número de un tipo de leucocito por mm cúbico de sangre.
WBC = recuento de leucocitos (número de leucocitos por mm cúbico de sangre).
%TL = porcentaje que representa ese tipo de leucocito con respecto al resto.
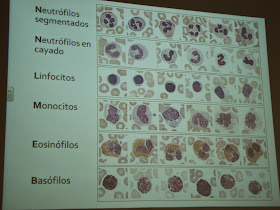
Interpretación clínica de los resultados obtenidos:
 |
| Fotografía: Libro de Hematología. |
Resolución de los objetivos propuestos:
-Se observan los leucocitos para determinar una fórmula leucocitaria con el objetivo de 10 x.
-Para el contaje de cada tipo de leucocitos de forma manual se deben hacer reparticiones o zonas tomando por cada zona un tipo de leucocito de referencia, aunque también se puede hacer el contaje siguiendo el método del zig-zag.
-Se han de observar al menos 200 leucocitos cuando se encuentre un mayor número de linfocitos que de neutrófilos ( en el adulto ) o más de un 10% de eosinófilos o más de un 12% de monocitos.
-Si de 100 leucocitos que hemos observado , 20 son linfocitos y el WBC es igual a 7.000 leucocitos/ mm cúbico de sangre, ¿cuál es el número de linfocitos que hay en 1 mm cúbico de sangre?
nº TL = (WBC x % TL) / 100 = ( 7.000 x 20 ) / 100 = 1.400 linfocitos / mm cúbico de sangre.
-El aumento de los mocitos se llama Monocitosis.
Valoración de los resultados:
En la sangre estudiada:
La proporción de leucocitos es normal, porque el número de cada tipo de leucocito se encontraba entre los valores normales.










.jpg)




.jpg)









